DES BIOMATÉRIAUX SONT UTILISÉS DANS L’INDUSTRIE POUR FABRIQUER DES PROTHÈSES ARTICULAIRES DESTINÉES À RÉPARER DES ARTICULATIONS ABÎMÉES. ILS SONT ÉGALEMENT UTILISÉS POUR PRODUIRE DES IMPLANTS D’OSTÉOSYNTHÈSE SERVANT À MAINTENIR EN PLACE ET STABILISER DE MANIÈRE TRANSITOIRE OU DÉFINITIVE DES OS FRACTURÉS : CE SONT LES PLAQUES, VIS, CLOUS, BROCHES, FILS MÉTALLIQUES…
- Introduction
Dans ce propos je vais éclairer sur la nature des matériaux entrant dans la fabrication des prothèses articulaires et des autres implants dont on se sert en chirurgie de l’appareil locomoteur (os et articulations essentiellement). Je vais aborder également la notion impropre au sens médicamenteux de « prothèses périmées ». J’en profiterai pour proposer un cadre codifié pour un emploi par nécessité des implants usagés dans certains pays eu égard au contexte de faible pouvoir d’achat. Ceci en vue d’une réduction des risques qui existent sous tous les cieux dans l’usage des biomatériaux.
- Définition
Les biomatériaux renvoient à un concept polysémique c’est-à-dire ayant plusieurs sens. Leur définition consensuelle a été fixée lors des conférences de la European Society for Biomaterials de Chester[1]au Royaume Uni en 1986 et 1991. Cette définition comporte :
Leur nature : ce sont des matériaux inertes non vivants(cela les différencie des greffes et transplantations d’organes). Ils peuvent cependant provenir d’organismes vivants (cas par exemple des substituts osseux provenant des coraux, de l’os de veau ou de l’os humain lyophilisé, c’est aussi le cas des fils de soie et de coquillages).
Leur utilisation : destinés à interagir avec les systèmes biologiques en vue de faire un diagnostic, de soigner ou remplacer un tissu biologique, un organe ou une fonction d’un corps (humain ou animal).
Leur durée de contact avec les systèmes biologiques : à partir de quelques heures[2].
Les biomatériaux ont connu leur essor après la deuxième guerre mondiale. Mais l’utilisation de matériaux inertes dans le corps humain remonte à plusieurs siècles voire millénaires. Confère mon article sur les prothèses articulaires[3].
- Les limites du sujet
Je m’arreterai essentiellement aux matériaux utilisés en chirurgie réparatrice et reconstructrice de l’appareil locomoteur (spécialité communément dénommée orthopédie-traumatologie). Sont donc exclus, les biomatériaux des autres systèmes du corps humain. Seront également exclus les substituts osseux destinés à combler les pertes de substance osseuse hormis les céramiques de phosphate. Je vais volontairement exclure également les implants résorbables comme les vis d’interférence utilisées lors des ligamentoplasties et tendinoplasties (réparation des ligaments : genou, cheville, coude, épaule…).
- Les grandes catégories de biomatériaux en chirurgie de l’appareil locomoteur
Les métaux et alliages métalliques
Les métaux biomatériaux en chirurgie orthopédique et traumatologique sont de trois ordres :
De l’acier inoxydable (inox) essentiellement pour tout ce qui est vis, plaques, clou, broches.
Des alliages de chrome-cobalt ou de chrome-nickel pour les prothèses.
Du titane et alliages de titane pour des plaques verrouillées, des vis, des clous, des prothèses. Le titane a une meilleure élasticité permettant des montages verrouillés mais souples qui ont moins de risque de rupture contrairement à l’acier inox.
Ces métaux ont la caractéristique essentielle d’être résistants à la corrosion dans l’organisme. Souvent on pense que des outils de chirurgie tels une pince, des ciseaux, un maillet… sont onéreux alors que d’apparence c’est la même chose que ce qu’on peut acheter dans un magasin de bricolage à moindre coût. La différence de prix est liée à la nature des alliages de métaux utilisés pour leur fabrication de manière à résister à la fois à la corrosion au contact du sang humain et aux cycles de stérilisations itératives. La ferraille standard ne satisfait pas à ces conditions. Elle se rouille et se casse au contact du sang.
Les polymères
Ce sont des matériaux de nature organique. C’est le composant « plastique » des prothèses. En premier lieu il y a le polyéthylène qui entre souvent dans les couples de friction tribologique (surface de contact articulaire, c’est une sorte de cartilage artificiel). C’est également ce que nous appelons le « ciment » pour sceller les implants à l’os. C’est du polyméthylmétacrylate (PMMA) : il est constitué pour l’usage d’une poudre de monomères pouvant être associée à des antibiotiques et d’un solvant. Le mélange des deux donne une pâte qui, en polymérisant devient dur et dégage de la chaleur. Nous utilisons également du silicone caoutchouc pour les prothèses des petites articulations inter phalangiennes des doigts et du polyester comme vis résorbables.
Les céramiques
À l’origine était l’artisanat avec la poterie et la cuisson de l’argile. Selon le CTIOA, Ceramic Tile Institute of America, une céramique est : « un article ayant un corps vitrifié ou non, de structure cristalline ou partiellement cristalline, ou de verre, dont le corps est formé de substances essentiellement inorganiques et non métalliques, et qui est formé par une masse en fusion qui se solidifie en se refroidissant, ou qui est formé et porté à maturité, en même temps ou ultérieurement, par l’action de la chaleur »[4].
Par définition, les céramiques sont contrairement aux deux premières catégories de biomatériaux, des matériaux non métalliques et non organiques issus de la fusion à très haute température d’oxydes d’alumine ou de zirconium. D’autres céramiques sont obtenues soit à partir de borure, de carbure ou de nitrure ou de mélanges. Dans la chirurgie de l’appareil locomoteur nous n’utilisons plus que la céramique d’alumine, celle de zirconium ayant été à l’origine de ruptures d’implants. Les autres céramiques sont utilisées dans d’autres domaines de l’industrie comme l’aéronautique, l’espace, l’armement…. À cause de la très haute température de fusion, le moulage comme pour les implants en métaux est quasi-impossible. On travaille donc sur des poudres de céramique pressées à froid puis on usine l’implant obtenu afin de polir la surface de friction articulaire de la prothèse.
Ci-dessous les biomatériaux utilisés pour la fabrication des implants prothétiques et d’ostéosynthèse[5].
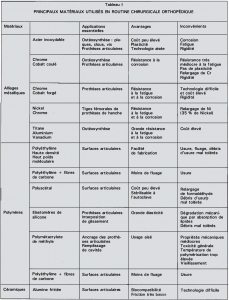
5. Propriétés mécaniques des biomatériaux[6],[7]
C’est la caractérisation du comportement des biomatériaux sous l’effet d’une contrainte. On appelle contrainte, une force qui s’exerce par unité de surface du matériau. Il en existe trois sortes élémentaires : la traction qui tend à allonger le matériau, la compression qui tend à réduire le volume du matériau et le cisaillement qui tend à découper le matériau. Les autres comme la flexion ou la torsion par exemple sont des associations de contraintes élémentaires. La déformation d’un matériau résultant de l’application d’une contrainte peut être mesurée en pourcentage (E – E0) / E0. (E0 etE pour états initial et final du matériau respectivement). La possibilité de déformation, sa stabilité, sa réversibilité totale ou partielle, son importance par rapport à l’intensité de la contrainte… déterminent les propriétés mécaniques non exhaustives que je vais aborder sommairement. Les essais de ces propriétés sont normatifs aux standards d’origine britannique (ISO = international organization for standarzation), française (AFNOR = agence française de normalisation) ou européenne (CEN = comité européen de normalisation).
5.1 Élasticité et son opposé : la Rigidité
C’est la capacité d’un matériau à reprendre sa forme initiale à l’arrêt d’une contrainte qu’on lui applique. Cette propriété est mesurée par le module de Young : c’est la contrainte théorique sous laquelle un matériau mis en traction doublerait sa longueur. Autrement dit, c’est le rapport entre la contrainte et la déformation. Plus cette contrainte est faible, plus le matériau est dit élastique voire flexible ou souple comme c’est le cas des matériaux organiques comme les polymères. Plus le module de Young d’un matériau est élevé, plus le matériau est dit rigide. Un matériau rigide peut néanmoins être plastique, malléable ou ductile. En chirurgie orthopédique, par exemple l’ensemble os-ciment-polyéthylène dans le cotyle a une élasticité harmonieuse car les trois éléments ont des modules d’élasticité proches comparés aux autres associations comme os-métal-polyéthylène ou céramique.
5.2 Plasticité
Lorsqu’une contrainte en traction augmente d’intensité la rupture du matériau peut intervenir. La phase entre la limite d’élasticité et la rupture constitue la plasticité. Le matériau déformé dans cet état ne retrouve plus sa forme initiale. Un matériau plastique se déforme facilement sans retourner à son état initial.
5.3 Fatigabilité
C’est la capacité d’un matériau à conserver sa résistance à la rupture sous l’effet de contraintes répétées. La rupture sous contraintes répétées détermine la fatigue du matériau par progression d’une fissuration.
5.4 Malléabilité – Ductilité et leur opposé : la Fragilité
La malléabilité est la propriété d’un matériau à conserver une nouvelle forme acquise à froid ou à chaud sous l’effet d’une contrainte de choc ou de pression. Elle conditionne la ductilité qui est l’extension de la malléabilité. La ductilité mesure l’importance de la déformation plastique avant rupture. Lorsque la ductilité est réduite ou nulle, le matériau est dit fragile.
5.5 Ténacité
C’est la capacité d’un matériau à résister à la propagation d’une fissure. C’est la quantité d’énergie absorbée à la rupture. Cela détermine la résistance aux chocs. C’est le cas des céramiques qui, quoique fragiles sont très tenaces.
5.6 Dureté
C’est la résistance d’un matériau à la déformation plastique localisée lorsqu’une contrainte est appliquée à sa surface. La qualification de cette propriété utilise l’échelle de rayure de Mohs. Un matériau A est dit plus dur qu’un matériau B si A raye B et B ne raye pas A. Son opposé est la propriété des matériaux mous.
5.7 Fluage
Lorsqu’une contrainte constante est appliquée à un matériau avec une intensité en dessous du seuil de plasticité, la déformation irréversible qui en résulte au bout d’un certain temps constitue le fluage. C’est le cas des inserts en polyéthylène dans les prothèses articulaires. Avec le temps, ces inserts peuvent se « laminer » sous l’effet de la contrainte constituée par le poids du patient porteur et qui est transmise par la tête (inox ou céramique) de la tige fémorale (prothèse totale de hanche) ou le bouclier fémoral (prothèse totale de genou). Cela peut conduire à l’usure libérant non pas des ions mais des particules de polyéthylène source de granulome à corps étranger autour des prothèses pouvant occasionner leur descellement.
5.8 Résistance à la rupture
C’est la contrainte maximale qu’un matériau peut subir avant de se rompre, qu’il soit élastique, plastique, malléable ou ductile. Pour les implants, l’existence de défauts de fonte ou d’usinage peut diminuer la résistance à la rupture. Un matériau très résistant à la rupture peut être fragile, c’est le cas des céramiques car leur ductilité est nulle.
5.9 Résilience
Lorsqu’avant le test de résistance à la rupture on réalise une entaille dans le matériau et qu’on y applique la contrainte, la résilience correspond à la capacité du matériau à résister malgré l’entaille.
5.10 Résistance à l’usure en tribologie
Cela concerne les pièces en frottement dans les prothèses articulaires. Sur un plan purement mécanique, l’usure de surface fait intervenir essentiellement le phénomène de rayure en rapport avec la dureté des matériaux qui va libérer des particules. Ces dernières vont jouer un rôle abrasif détériorant davantage la surface de frottement. A cela il faut ajouter le phénomène de fluage décrit plus haut ainsi que la corrosion et d’autres phénomènes physico-chimiques du corps humain participant de l’usure. Les débris libérés par l’usure occasionnent des granulomes à corps étranger liés aux macrophages qui tentent de phagocyter les débris, de même qu’une coloration noirâtre des tissus par des débris métalliques qu’on appelle métallose.
- Propriétés physiques et chimiques des biomatériaux
6.1 Densité
C’est la quantité de matière par unité de volume exprimée en grammes par centimètre cube par exemple. Elle dépend de la masse atomique des éléments constitutifs du matériau mais aussi de sa compacité physique.
6.2 Porosité – Compacité
C’est le rapport entre le volume aérique (pores) contenu dans un matériau et le volume global du matériau. Son inverse est la compacité du matériau. Plus un matériau est compact et moins il est poreux.
6.3 Oxydation
C’est un phénomène électrochimique, dans le cas qui nous concerne, au contact des tissus et fluides du corps humain au cours duquel le matériau cède des électrons. Le corps récepteur d’électrons se trouve ainsi réduit pendant que le matériau s’oxyde dans une réaction d’oxydo-réduction. La conséquence est une corrosion dans la durée. Les deux principaux oxydants en cause sont le cation hydrogène H+ responsable de l’acidité (le PH) et le dioxygène O2.
6.4 Corrosion – Effet pile
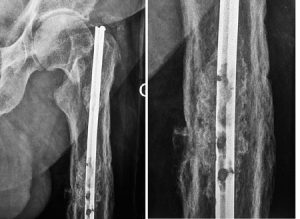
Tous les matériaux sont susceptibles de corrosion dans l’organisme humain. C’est la résultante de l’oxydation qui va participer de l’usure des pièces métalliques. Plusieurs phénomènes peuvent aboutir à la corrosion des biomatériaux métalliques. L’abrasion mécanique de la couche passivée protectrice ou son attaque par acidification locale liée à la présence de certains germes va conduire à la création d’une crevasse, point de départ d’une zone de fragilité. L’étude des matériels explantés[8]montre que les aciers à gros grains sont plus sujets à la corrosion. De même, les zones de contact vis-plaque se corrodent plus facilement. Les plaques résistent moins à la corrosion que les clous centromédullaires. L’image ci-contre représente un clou ayant subi une corrosion sur 56 ans. (image https://www.maitrise-orthopedique.com/articles/trucs-et-astuces-pour-lablation-de-clous-centromedullaires-571).
Effet pile : c’est la corrosion galvanique qui peut se produire lorsque les trois conditions suivantes se réalisent :
- Soit des métaux de natures différentes, soit entre un alliage de métal et ses impuretés, soit entre une zone modifiée d’un métal et le reste du métal : C’est la différence de potentiel de dissolution entre deux qui provoque le phénomène.
- La présence d’un électrolyte : La présence d’ions dans les humeurs aqueux du corps humain accélère le phénomène.
- La continuité électrique entre deux.
Le transfert de charges électriques et d’ions qui en résulte va provoquer un phénomène de corrosion pouvant occasionner une ostéolyse (fonte de l’os) localement comme s’il s’agissait d’une infection.
6.5 Bio compatibilité
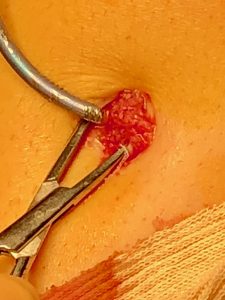
La European Society for Biomaterials définit la biocompatibilité comme la « capacité d’un matériau à induire une réponse appropriée de l’hôte dans une application spécifique ». Ceci suppose l’absence de toxicité locale ou générale et surtout exclusion de toute substance cancérigène. Certains organismes peuvent cependant présenter des allergies à certains éléments des biomatériaux tels le Nickel ou le Chrome, respectivement l’allergie aux bijoux fantaisistes et au ciment de maçonnerie. L’mage ci-dessous correspond à un granulome développé sur l’extrémité coupée d’une broche en titane et qui est dû aux débris du métal lors de sa section à la pince coupante. Il s’agit d’une accumulation de macrophages et autres cellules de défense donnant cet aspect de « grains de sable »
6.6 Bio intégration
C’est la colonisation du matériau par des cellules de l’organisme. En chirurgie osseuse, c’est les céramiques phosphocalciques qui favorisent cet effet. Ce sont l’hydroxyapatite, le bêta tricalcium phosphate, le carbonate de calcium ou des associations.
- Modes de stérilisation – durées de validité
Les biomatériaux en chirurgie osseuse sont actuellement pour la plupart fournis conditionnés stérilement et prêts à être implantés. Mais il existe encore des plaques et vis en inox qui sont stérilisées par les utilisateurs avant leur implantation. Les prothèses articulaires sont toujours fournies stériles et conditionnées.
Les méthodes de stérilisations sont diverses.
Au sein des établissements de santé et en fonction des pays, on utilise encore des méthodes anciennes comme le formol (c’est le cas des moteurs artisanaux en chirurgie osseuse dans certains pays). Certaines méthodes de désinfection par des substances liquides sont parfois assimilées à une « stérilisation ». La technique de choix est celle de l’autoclave qui utilise de la vapeur autour de 120°. La chaleur sèche entre 110 et 250° selon la méthode de Gaston Poupinel élève de Louis Pasteur est aujourd’hui proscrite en France mais encore utilisée ailleurs. Sont également utilisées des méthodes gazeuses (oxyde d’éthylène, le peroxyde d’hydrogène, l’ozone, l’acide paracétique, le dioxyde de chlore). La méthode en vigueur en France au sein des établissements de santé dont la plupart recourent actuellement à des services centralisés et spécialisés de stérilisation avec une traçabilité de toute la chaîne depuis la décontamination jusqu’aux conditionnements est celle de l’autoclave avec des emballages réglementés. La traçabilité informatisée utilise des codes barre nominatifs.
Les méthodes industrielles basées sur des rayonnements ionisants :
En tout premier lieu les rayons gamma produits par du Cobalt 60 radioactif. Les faisceaux d’électrons accélérés. Les rayons X. Les rayons gamma ont une très grande efficacité. Ils agissent sans chaleur en détruisant le génome des micro-organismes permettant ainsi de rendre stériles les implants pré conditionnés qui sont bombardés par ces rayons. Selon plusieurs auteurs, la validité des implants stérilisés aux rayons gamma est à vie tant que le conditionnement n’est pas altéré[9],[10],[11].
- La question des implants d’occasion dits « second hand »[12]
Les conditions de faible revenu des patients leur rendent souvent inaccessible l’achat d’implants neufs stériles ou non en vue d’une opération sur les fractures. D’ailleurs parfois les opérations urgentes sont retardées de plusieurs semaines le temps que l’entourage réunisse les fonds nécessaires en vue d’acheter le matériel. Ceci conduit régulièrement à recourir à du matériel ayant déjà servi et récupéré lors d’une ablation de matériel après consolidation d’une fracture. Il s’agit d’implants d’occasion ou dits « second hand ». L’utilisation de tels implants est interdite en France par exemple. La réglementation n’est pas claire dans bon nombre de pays dans lesquels même des équipes de chirurgiens occidentaux utilisent en toute transparence ce type de matériel d’occasion. Les risques que cela comporte doivent être connus et contrôlés en vue d’une meilleure sécurité patients.
À part est le risque de maladie de Creutzfeldt-Jakob et autres encéphalopathies spongiformes transmissibles (EST) : ce sont des maladies du système nerveux liées aux prions, organismes plus élémentaires que les virus. C’est la fameuse maladie de la vache folle et autres tremblantes du mouton et de la chèvre. Tout matériel chirurgical, réutilisable ou non ayant été au contact a fortiori de tissus nerveux ou lymphoïde (rate, ganglions, foie, intestins…) est séquestré en vue d’un traitement de décontamination suivant une procédure spéciale. Telle est la réglementation car les prions peuvent résister aux modes de stérilisation usuelles. Dès lors la logique voudrait qu’un implant ayant été retiré sur un patient présentant des risques (à définir) soit exclu de tout ré-usage.
8.1 Modifications des propriétés des matériaux ayant séjourné dans le corps humain
La stabilité des biomatériaux est modifiée par le contact avec les systèmes biologiques. Cela a une incidence sur leurs propriétés mécaniques et physico-chimiques. Il va sans dire que lors de la première pose de même que lors de l’ablation, des phénomènes de piquetage et de rayures vont créer des zones d’amorce de corrosion in vitro puis in vivo lors de la réutilisation. A cela il faut ajouter les déformations mécaniques de vrillage, de torsion, de flexion… voire de microfissures sources de fatigue de l’implant.
8.2 L’« effet pile »
Il existe un risque augmenté lors des réutilisations. Il peut arriver des associations de pièces provenant de fabricants différents donc des matériaux probablement de nature différente même pour l’acier inox dont la composition peut varier. A cela s’ajoute la détérioration de la couche passivée liée à l’usage itératif.
8.3 Risques liés aux restérilisations itératives
8.3.1 Risque infectieux
Nous avons déjà évoqué le risque d’encéphalopathie spongiforme transmissible et la maladie de Creutzfeldt-Jakob. Les méthodes de stérilisation surtout à la chaleur sèche peuvent épargner des germes incrustés dans du sang ou du tissu biologique (os, fibrose…) prisonniers d’un implant creux comme du clou centromédullaire. Or la chirurgie osseuse est une chirurgie hyper propre.
8.3.2 Fragilisation par la chaleur
Les méthodes de stérilisation comme les rayons gamma qui protègent l’intégrité des implants ne sont pas accessibles aux établissements de santé surtout dans les pays à faible revenu. La chaleur surtout sèche va entrainer une détérioration des implants et l’apparition de zones de fragilité. La conséquence logique est une augmentation du risque de rupture du matériel ou l’instabilité des montages qui vont grever les chances de consolidation des fractures.
8.4 Augmentation des difficultés et des risques lors des ablations de matériel
L’ablation des matériels d’ostéosynthèse peut se révéler un geste chirurgical parfois périlleux. Les risques habituels se trouveront multipliés pour les raisons évoquées avec plus de têtes et de pas de vis foirés, de filetages de clous foirés rendant laborieux voire impossible leur retrait, des soudures à froid, des clous et vis cassés lors de l’ablation…
- Conclusion : Que faire pour limiter les risques ?
Cela devra passer par une codification tenant compte tenu du contexte de faible pouvoir d’achat.
Sélection des alliages autorisés pour la réutilisation afin d’éviter l’effet pile et avoir une bonne résilience du matériau.
Traçabilité de la provenance du matériel précédemment utilisé et surveillance du patient nouvellement implanté.
Limite de la durée de la première utilisation (séjour dans un corps humain) et du nombre de cycles de réutilisations.
Réunir un certain nombre des conditions telles que l’intégrité des implants (non rayés, piqués ni déformés), le choix du mode de restérilisation, la durée prévisible du nouveau portage.
Information du patient sur la nature du matériel qui lui est implanté.
Cette codification devra être la mission d’un groupe de travail d’experts ingénieurs de la physique des matériaux, de chirurgiens de l’appareil locomoteur, de microbiologistes et d’hygiénistes. C’est un enjeu de santé publique.
[1]Park J. et Lakes R. : Biomaterials : An Introduction, Éditions Springer 2007
[2]Biomatériaux : Rapport rédigé sous la coresponsabilité de Laurent SEDEL, Président de l’Inter commission n° 1 de l’INSERM – Faculté de Médecine Lariboisière – Paris et Christian JANOT, Professeur à l’Université Joseph Fourier – ILL – Grenoble, Cahiers de l’institut national de la santé et de la recherche médicale
[3]http://docteuralovor.com/5008-2/
[4]http://www.ctioa.org/index.cfm?pi=GL&gaction=list&grp=C
[5]Pascal Christel : Biomatériaux et Chirurgie Orthopédique, Médecine et Science n ° 10 vol. 2, décembre 1986, pages 573-78
[6]Kurz WK, Mercier JP, Zambelli G. : Introduction à la Science des Matériaux. Presses Polytechniques et Universitaires Romandes
[7]Mokaddem Allel et Boutaous Ahmed : Structures et propriétés des biomatériaux, Cours en ligne de la faculté de physique de l’Université d’Oran (Algérie) 2014 / 2015
[8]F. Mdari et al, Analyse microscopique des mécanismes de corrosion des plaques d’ostéosynthèse en acier inoxydable 316L, Phys. Chem. News 8 (2002) 61-68
[9]TA du Plessis, The shelf life of sterile medical devices,SA Orthopaedic Journal Summer 2014, Vol 13, n°4
[10]Kátia Aparecida da Silva Aquino, Sterilization by Gamma Irradiation, Federal University of Pernambuco-Department of Nuclear Energy Brazil
[11]http://africa-talents.com/togo-prof-dossim-assang-michel-le-materiel-utilise-sur-les-patients-nest-jamais-perime-sil-ya-eu-des-morts-cela-est-du-a-autres-causes/amp/
[12]CG J Saris, C ABastianen, E C AMvan Swieten, H JWegdam FGCS: Infection rate in closed fractures after internal fixations in a municipal hospital in Ghana, Tropical Doctor 2006; 36: 233–235






Répondre
Vous devez vous identifier pour commenter.